Dres. Luis Bracamonte Ortiz, Hernán Aste Salazar, Oscar Talledo Quaglino, Lourdes Torres Ruiz, Eleodoro Barreda Delgado
Resumen
El uso de conductos arteriales, específicamente de la arteria mamaria izquierda, se popularizó a fines de los años 80 e inicios de los 90. Pero no ocurrió igual con el uso de las dos mamarias a pesar de existir trabajos favorables a su utilización. Les presentamos nuestra experiencia consecutiva de 50 pacientes coronarios con dos mamarias operados entre Enero de 1991 y Junio del 2000. El objetivo del trabajo es evaluar la morbimortalidad de este procedimiento a corto plazo y la morbilidad a distancia, al igual que la sobrevida. Los resultados inmediatos mostraron una mortalidad operatoria de 0% y una morbilidad muy baja. En el seguimiento a 9 años de 42 pacientes (84% del grupo), la sobrevida fue de 100% y no existieron complicaciones cardiológicas en el 92.8% de pacientes evaluados. Basándonos en las múltiples publicaciones recientes favorables al uso de dos mamarias y en nuestros propios resultados creemos que esta modalidad de trabajo debe difundirse dado que ha sido demostrada la disminución de la morbilidad cardiológica a largo plazo, la disminución del riesgo de reoperaciones y finalmente, que aumenta significativamente la sobrevida de los pacientes en comparación de aquellos en los que se usa exclusivamente venas o una sola mamaria.
Palabras clave: Cirugía coronarias, mamarias, bilateral, resultados.
Summary
Excellents results were achieved with coronary artery bypass operations using a single internal thoracic artery (ITA) grafts to the left anterior descending coronary artery. But this situation was not reproduced with bilateral ITA results. The benefit of additional arterial conduits has been supported by some and disputed by others. Between January 1991 to June 2000 we operated 50 consecutive patients with the use of bilateral ITA grafts. We present the short-term results, the nine years follow-up and the survival. Thirty-day mortality was 0% with a very low morbidity. The follow-up of 42 patients (84%) showed a survival of 100 % without cardiologic events in 92.8% of operated patients. On the basis of data from the last years, the favorable impact of bilateral ITA graft on the hard end point of reintervention, cardiologic events and death has been confirmed at long-term results. We conclude that revascularization with bilateral ITA grafts must be expanded and our results support this concept.
Key words: Coronary surgery, internal thoracic arteries, bilateral, results.
Introducción
La Cirugía coronaria con conductos arteriales no es nueva. En 1950 Vineberg (1,2) utilizaba una o dos arterias mamarias (AMI) colocándolas en el ventrículo izquierdo a través de túneles construidos en el músculo cardiaco con la idea de llevar sangre al tejido isquémico y crear nuevos canales de irrigación: El procedimiento quedó en el olvido luego que Favaloro en 1971 (3) publicara la técnica de revascularización con vena safena, suturándola directamente en la aorta y en la coronaria. En 1986 Loop (4) demuestra que el uso de la arteria mamaria izquierda (AMIi) colocada en la arteria descendente anterior (DA) tiene mayor permeabilidad a 10 años que la vena, las personas viven más y con menos eventos cardíacos que aquellos en los cuales sólo se usa vena. Actualmente nadie discute el valor de la AMIi, se le usa en forma sistemática y constante, representando un elemento básico de la cirugía coronaria moderna.
Con el uso de la AMIi vino el interés por usar otros conductos arteriales, entre ellos la AMI derecha (d) la arteria gastroepiploica (AGE), la arteria epigástrica (AE) y últimamente la radial (AR). El sustento racional era que si un conducto arterial (AMIi) tenía mejor patencia que la vena safena y mejores resultados a largo plazo, lo lógico seria que colocando otros conductos arteriales para reemplazar las venas, se obtendría igualmente mejores resultados. Sin embargo la tesis no ha sido fácil de demostrar y hasta el día de hoy han existido grupos a favor y en contra. Es indudable que trabajar con conductos arteriales aumenta la dificultad técnica y puede aumentar la morbilidad pero nosotros creemos que, con la experiencia necesaria, la utilización de las dos AMI y otros conductos arteriales son beneficiosos para el paciente. Una buena selección del paciente unido a una técnica depurada puede dar resultados satisfactorios sin aumentar la morbilidad quirúrgica y con buenos resultados a largo plazo.
Les presentamos nuestra experiencia en un grupo de 50 pacientes en quienes hemos hecho revascularización coronaria con dos arterias mamarias.
Material y métodos
Población
Desde el mes de Enero de 1991 a Junio del 2000 el grupo Cirujanos Torácicos y Cardiovasculares Asociados (CITOCARDIA) ha efectuado 448 cirugías de coronarias.
En 50 casos consecutivos se utilizaron dos arterias mamarias lo que representa el 11% de la casuística total del grupo y el 23% de la casuística de uno de los cirujanos (LB).
Uno de los pacientes en quien se utilizó 2 AMI recibió además 1 AGE (HA). De los 50 pacientes con doble AMI, 47 pacientes fueron operados por el mismo cirujano (LB), los otros 3 casos por otro de los cirujanos del grupo (HA).
Las características preoperatorias de los pacientes están resumidas en la Tabla 1. Todos los pacientes fueron de sexo masculino y las edades fluctuaron entre 41 y 71 años. La cirugía fue electiva en 44 pacientes (88%), lográndose una revascularización completa en 48 pacientes (98%). El número de puentes realizados, los tiempos de circulación extracorpórea (CEC), de clampaje aórtico (isquemia) y otros datos operatorios se presentan en la Tabla 2.
Todos los casos se hicieron con CEC a excepción de dos casos que se operaron a corazón batiente (Sin CEC).
Técnica quirúrgica
En la inducción anestésica los pacientes recibieron Propofol o Midazolan más Fentanil e Isofluorane que también se utilizó durante el período de CEC. Se disecaron simultáneamente las AMI, las otras arterias y las venas safenas. La técnica de disección de las AMI la hemos descrito anteriormente (5) pero deseamos agregar que actualmente otorgamos especial importancia a fulgurar solo el borde anterior o medial de la AMI, paralelo a ella y en todo su trayecto sin quemar el borde posterior o lateral. Cuando disecamos el borde anterior y la AMI cae, seccionamos con tijera el borde posterior (Fig. 1). Actualmente, a diferencia de años anteriores, disecamos en primer término la AMIi y luego la AMId, este cambio se debe probablemente al hecho de contar con instrumental más adaptado para la preparación de la AMI. Una vez disecadas ambas AMI se les aplica tópicamente Papaverina o Nitroprosiato de Na diluido y se les deja envueltas en una compresa embebida en la misma solución. Se procede inmediatamente a la apertura del pericardio y a la canulación en forma única de la aorta ascendente y de la aurícula derecha. En ese momento, observando la calidad de las coronarias, el tamaño del corazón y la longitud de los conductos es cuando se decide que hacer. Se utilizan “in situ” (sin seccionar) o se secciona la AMId (Puente libre – Free-Graff) (6). En algunas casos hemos colocado la AMId “in situ” sobre la DA, atravesando el campo operatorio, ubicándola por detrás del esternón; en ese caso la AMIi se coloca sobre otra coronaria del sistema izquierdo del corazón (ventrículo izquierdo). En otros casos lo que hacemos es utilizar la AMId como puente libre para revascularizar el segundo mejor vaso coronario luego de la DA. En la Tabla 3 les mostramos toda la combinación de revascularizaciones efectuadas.
En cuanto al orden, siempre hemos comenzado anastomosando los puentes venosos distales luego los puentes libres arteriales distal y proximalmente. A excepción de dos casos siempre hemos podido hacer la sutura proximal del puente libre de AMI en la aorta; la condición para hacerlo es que la aorta sea sana, sin calcio y de un espesor normal, la otra condición es que la boca proximal de la AMI sea lo suficientemente grande (2mm o más), si no es así es preferible implantarla sobre una vena; en los dos casos señalados se debió una a cada causa. Cuando se utiliza la aorta empleamos un sacabocado (“Punch”) número 4 y hacemos la anastomosis con prolene 6/0 en surget continuo. Salvo excepciones, la boca proximal de la AMI es suficientemente grande para permitir hacer la anastomosis sin problemas. Una vez finalizado el puente se fija al corazón con un punto para evitar su rotación y que pueda en consecuencia comprometer el flujo de sangre. Finalmente se hacen las anastomosis distales de los puentes “in situ” utilizando prolene 7-0 u ocasionalmente prolene 8-0 cuando la AMI y las coronarias son muy finas. En un caso se usó la AGE, disecándola de la curvatura mayor del estómago a través de una prolongación de 5 a 8 cm de la incisión torácica hacia el epigástrico (Figura 4). La AGE se lleva por su extremo distal a través del diafragma para revascularizar la arteria descendente posterior (DP) rama de la coronaria derecha (CD). Todas las anastomosis proximales y distales se hicieron bajo un solo clampaje total de la aorta. Se bajó la temperatura corporal moderadamente (30-32°C) y se usó sangre fría (10°C) diluida como cardioplegia de inducción, con reperfusiones cada 20 minutos por la aorta, los puentes y cuando se consideró necesario a través del seno coronario (retrograda). En todos los casos se uso una reperfusión con sangre caliente (32°C) antes del declampaje de la aorta. En todos los casos, igualmente se usó oxigenadores de membrana y bomba centrífuga para disminuir los problemas de lisis de glóbulos rojos y otros elementos de la sangre.
En dos casos no se utilizó CEC, se utilizaron las dos AMI y se anastomosaron a corazón batiente con la ayuda de un estabilizador metálico que disminuye el movimiento de la zona del corazón donde se va a hacer la anastomosis (Figuras 2 y 3).
Al salir de CEC tratamos siempre de asegurar una buena presión de perfusión (P.S > 100 mm Hg.) necesaria para que los puentes arteriales se expandan bien, se dilaten al máximo y la perfusión sea correcta. Una vez fuera de CEC y lograda la estabilidad hemodinámica asociamos nitroglicerina EV a la terapeútica habitual, por unas horas, para evitar la posibilidad de espasmos en los conductos arteriales.
Se hace una hemostasia minuciosa de las colaterales de las AMI de las anastomosis y de los lechos de las AMI. Dejamos un drenaje en las cavidades torácicas si las pleuras se abrieron. En el post-operatorio inmediato tratamos de evitar las crisis hipertensivas que pueden producir tensión y sangrado en las anatomosis o en las ramas arteriales (7).
Seguimiento
Se han evaluado los pacientes durante el período peri-operatorio para conocer la mortalidad operatoria (M.O.) durante los 30 días posteriores a la cirugía o durante la duración de la hospitalización; también se han evaluado las complicaciones post-operatorias siguientes: Infarto de miocardio agudo (IMA) definido como nueva onda Q o elevación irrefutable de enzimas, reoperación por sangrado, mediastinitis o infección esternal (fiebre, cultivos positivos, presencia de pus más inestabilidad esternal). Insuficiencia respiratoria (> de 24 horas de ventilación mecánica) y accidente cerebro vascular (definitivo o transitorio, periférico o central).
Posteriormente al alta se ha efectuado un seguimiento a largo plazo de los pacientes a través de las historias clínicas, sus médicos tratantes y directamente con los pacientes a través de cuestionarios o por medio del teléfono. La información solicitada fue: Presencia o ausencia de angina, evidencia de isquemia (Prueba de esfuerzo, Ecocardiografía, prueba de esfuerzo o basal con radioisótopos), evidencia de nueva revascularización (PTCA, STENT, reoperación), sobrevida o causa de muerte tardía.
Resultados
Se obtuvo una revascularización completa en 48 pacientes (98%). La cirugía fue electiva en 44 pacientes (88%) y de urgencia en 6 (12%). El número de puentes promedio por paciente fue de 4.3 de lo cual se deduce que parte de la revascularización se completó con venas. Veintiún pacientes (42%) estaban en angina inestable, situación que no impidió preparar las dos AMI u otros conductos. La fracción de eyección (FE) promedio fue buena (53%) pero hubo pacientes con 25% y otros que tenían 70%. Los tiempos de CEC y de clampaje aórtico son discretamente elevados en relación a cirugías con venas únicamente o con una AMI, lo cual se explica por la mayor exigencia técnica y necesidad de disponer de más tiempo para valorar el tipo de cirugía que se va a hacer, bien calcular la longitud de los conductos y tomarse el tiempo necesario para hacer las anastomosis de los puente libres sin complicaciones.
En pocos casos se usaron anastomosis secuenciales. En un caso se utilizaron 3 conductos arteriales. Los puentes secuenciales o el uso de más arterias es indudable que aumenta el tiempo de CEC, sin embargo estos tiempos aumentados no ocasionaron mayor morbilidad perioperatoria como se puede ver en las pocas complicaciones que han tenido los pacientes (Tabla 4).
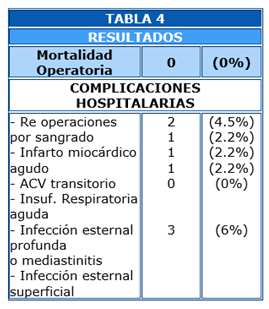
La mortalidad operatoria para la serie de 50 pacientes consecutivos fue cero (0%).
Dos pacientes (4.5%) fueron reoperados por sangrado. Un paciente (2.2%) mostró IMA con onda “q” nueva. No hubo ningún caso de infección esternal o mediastinitis (0%). En 3 casos (6%) hubo infección superficial leve de la cicatriz torácica que cedió con curaciones locales a los pocos días; y en un caso se resuturó el esternón por fractura del 1/3 distal sin presencia de infección. Un paciente presentó un ACV transitorio (2.2%). También hubo un solo caso (2.2%) de insuficiencia respiratoria y en un paciente se constató parálisis del frénico derecho sin consecuencias clínicas (2.2%).
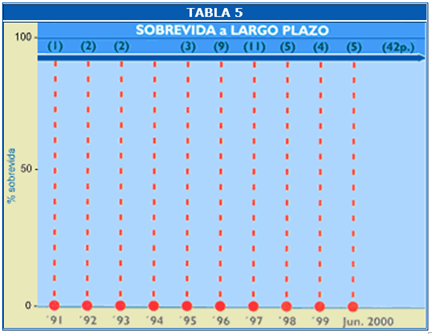
Se hizo el seguimiento a largo plazo (9 años) de 42 pacientes que representa el 84% del grupo total. 40p tuvieron evaluación con Ecocardiografía, prueba de esfuerzo o estudio de radioisótopos; de este grupo, en 37p (92.5%) las pruebas fueron negativas para isquemia. Los dos pacientes sin evaluación se encuentran asintomáticos sin pruebas objetivas que demuestren ausencia de isquemia.
En ningún caso se ha efectuado cateterismo cardiaco luego de la cirugía, ningún paciente ha sido sometido a revascularización secundaria no quirúrgica (PTCA, STENT) o quirúrgica. La sobre vida a 9 años de los pacientes evaluados es de 100% (Tabla 5).
Discusión
Que los médicos acepten el uso de conductos arteriales no ha sido un proceso fácil. En 1975 sólo 5.7% de cirujanos en USA utilizaban la AMI, 13% en 1980. A consecuencia del trabajo de Loop (4) ya mencionado, se difundió su uso en forma masiva (65% de cirujanos en USA en 1990). Actualmente no colocar AMIi se considera como un factor más de riesgo de mortalidad operatoria agregado al paciente, por lo tanto, el cirujano debe tener argumentos muy sólidos para justificar el no servirse de ella (8).
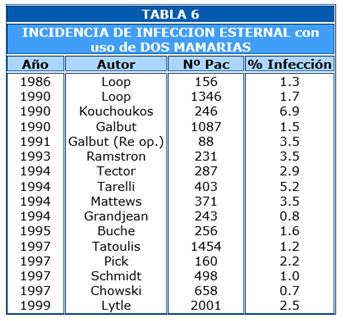
Demostrar que dos AMI son mejores que una AMI ha pasado por un proceso similar pero con mayor dificultad pues no era evidente el beneficio sin embargo la morbilidad podía aumentar: mediastinitis, sangrado, síndrome de hipoperfusión. Se sabe que la disección de las dos AMI disminuye la irrigación del esternón y eso favorece las infecciones más que con el uso de una AMI, pero no en el porcentaje que fue señalado por Kouchoukos (9%) en el año de 1990 (9). Prueba de ello son los múltiples trabajos posteriores (10-13) publicados durante la década pasada como se muestra en la Tabla 6. Dichas cifras confirman que el riesgo de infección es mayor pero en un porcentaje mucho menor que el que fue señalado a inicio de los años 90. Durante la curva de aprendizaje, que se presenta con cualquier técnica nueva, puede haber mayor sangrado post-operatorio, hipoperfusión coronaria, en una palabra mayor morbilidad, a lo cual se agrega la mayor dificultad técnica. Todos estos factores explican la resistencia a usar dos arterias mamarias u otros conductos arteriales. Sin embargo con los años y la experiencia se aprendió a utilizar las 2 AMI en forma más selectiva con baja morbimortalidad y sobre todo se conocieron las contra indicaciones a su uso como son la diabetes en tratamiento, la obesidad y la presencia de enfermedad pulmonar obstructiva crónica (EPOC) la cual puede aumentar el riesgo de ventilación mecánica prolongada y por tanto las infecciones.
En 1990 Fiori (14) publica un trabajo de 15 años de seguimiento en el cual encuentra mayor sobrevida y menos eventos cardiacos post-operatorios en pacientes con dos AMI comparadas a pacientes con una AMI. Pero esos resultados no fueron reproducidos en los años siguientes por otros grupos, a pesar que Galbut (15), Little (16), Cosgrove (17), Dion (18), Accola (11) entre otros mostraban constantemente que la cirugía con dos AMI podía hacerse con una morbimortalidad similar a la cirugía con una AMI y que por lo tanto su uso estaba justificado. Schmidt (19) y Pick (20) en trabajos recientes encuentran que hay mayor sobrevida cuando se usan dos AMI en relación a una AMI, si es que ambas mamarias se colocan en coronarias del ventrículo izquierdo.
En 1999 Lytle (21) en un trabajo retrospectivo de 12 años compara 2,001p con dos AMI a 8,123p con una AMI, encontrando que en todos los grupos analizados (con diabetes o sin ella, con baja F.E o normal) aquellos que reciben dos AMI tienen estadísticamente menos riesgo de morir, de ser reoperados y de necesitar angioplastía que aquellos que reciben una AMI. Este trabajo es contundente y aclara definitivamente el panorama. Utilizar dos AMI es mejor que una pero no se debe olvidar que para tener buenos resultados y poca morbilidad se deben seleccionar bien los pacientes para evitar el riesgo de infección esternal que es bajo pero sigue siendo el doble cuando se compara con una AMI; 2.5% VS 1.4% (21). Eagle y Gytton en el reporte (ACC/AHA Guidelines for coronary bypass graft surgery) de Octubre de 1999 (8), reconocen los beneficios a largo plazo del uso de IMA bilateral en relación al uso de una AMI, señalando la menor recurrencia de angina, de infarto de miocardio, la menor recurrencia de reoperaciones y la mayor sobrevida a largo plazo. Tambien reconoce los “excelentes” resultados a corto y largo plazo de la AMId utilizada como “free-graft”. Finalmente recomienda tomar las precauciones necesarias para evitar las infecciones esternales serias.
Nuestra experiencia de revascularización con las dos arterias mamarias tiene más de 10 años, periodo en el cual las hemos utilizado en forma constante representando el 23% de nuestras indicaciones (LB). A partir de 1995 con aun más frecuencia lo que coincide con la decisión de colocar las AMI como injerto libre (56% de las AMI derechas) cuando fuera necesario; esta variante técnica permite acceder a cualquier arteria coronaria sin limitación de longitud (Tabla 3). Al respecto hay múltiples trabajos que demuestran la muy buena permeabilidad del puente libre de AMI, la cual es discretamente inferior al puente “in situ”, 92% Vs 98% (22-24).
La anastomosis proximal del puente libre en aorta es técnicamente más delicada de trabajar que la vena debido a que las paredes de la AMI son mas frágiles y no se deben pinzar, por otro lado la boca de la AMI proximal si bien no es pequeña es menos grande que la de la vena, es por eso que el agujero en aorta debe ser pequeño para evitar desgarros de la pared de la AMI al momento de construir la anastomosis. Y como ya se señaló anteriormente, si la dificultad es importante o la aorta de mala calidad sera mejor implantarla en la otra AMI o en la parte inicial de un puente venoso.
Un reciente trabajo de Buxton (25) muestra en un reestudio de 962p con mamaria bilateral, que la patencia de la AMId “in situ” sobre la DA es casi idéntica que la encontrada para la AMIi en las mismas circunstancias; lo que podría favorecer en el futuro la ubicación preferencial de la AMId en esa posición dejando la AMIi para otra arteria del lado izquierdo del corazón disminuyendo de ese modo la frecuencia del uso de free-grafts.
En un caso, además de las AMI, se colocó la AGE para la descendente posterior (DP), rama de la coronaria derecha (CD) (Figura 4). Creemos que esa es la mejor indicación de la AGE, el territorio derecho, sobre todo cuando la CD proximal está cerrada crónicamente, así en ese caso, no van a existir problemas de desproporción de flujo en el periodo perioperatorio, permitiendo que la AGE se desarrolle progresivamente. Otra situación donde debe ser utilizada es en pacientes jóvenes. (< 60 años) como tercera opción de conducto arterial (26-27).
A la implantación de un puente arterial proximal sobre la AMIi (“in situ”) se le llama revascularización en “Y” o en “T” y tiene mucha aceptación últimamente. Fue promocionada por Barra (28) y Tector (29) en 1994 y 1995 respectivamente; es técnicamente muy exigente, toma tiempo y tiene el problema que toda la circulación o gran parte de ella depende de una sola arteria, la AMI i; sin embargo hay publicaciones que mencionan que el flujo de sangre a través de la AMI es suficiente para abastecer todo el corazón (30). Lo que más se está usando en este momento es la asociación de AMIi con arteria radial (31-33). Puede ser muy útil por ejemplo, cuando no hay venas, cuando la aorta esta calcificada, en personas jóvenes y en aquellas situaciones en las que no se quiere utilizar las dos AMI.
Nuestros resultados (M.O de 0%) indican que la utilización de las dos AMI no son riesgo a tener en cuenta como factor que pueda aumentar la M.O, esa es también la experiencia de múltiples grupos quirúrgicos en los cuales sus resultados de M.O no se han visto influenciados por el uso de dos AMI (14-21). En lo referente a la edad, esta técnica de dos conductos arteriales y en especial las 2 AMI las hemos utilizado aún en gente de > de 70 años, sin tener más morbilidad que con el uso de una AMI. En nuestro grupo no las hemos usado en mujeres, nuestra opinión es que en nuestro medio la mujer es generalmente de pequeño tamaño con una superficie corporal igualmente pequeña con AMI que son generalmente delgadas y frágiles a lo que se agrega el hecho que son en general personas de edad avanzada con mayor frecuencia de diabetes.
Sin embargo Little en su serie de doble AMI (21) presenta un buen porcentaje de mujeres en las cuales no ha encontrado mayor morbilidad que en los hombres, lo que muestra que el sexo no debería en si mismo ser factor de exclusión.
Solamente en un caso de esta serie se usaron ambas AMI para una reintervención coronaria, se trataba de un paciente de 60 años que había recibido 4 puentes coronarios de vena 18 años antes. El autor consideró que en esta segunda operación se debían colocar conductos que alimentaran la esperanza de no tener que someter al paciente a una tercera cirugía en el futuro, situación probable, si se usaban solo venas, dada su edad y su buen estado clínico. Se usaron en concecuencia la AMId “in situ” a la DA y la AMIi “in situ” a la diagonal (Figura 5). Una de las ventajas más importantes del uso de dos AMI es la disminución del riesgo de reoperaciones, que en el trabajo de Little (21,34) es lo que más resalta por su contundencia estadística. En la Tabla 7 se comparan los riesgos acumulados de reoperación en una serie de pacientes operados entre 1971 y 1985; un grupo recibió solo venas, otro grupo una AMI y un tercer grupo dos AMI.
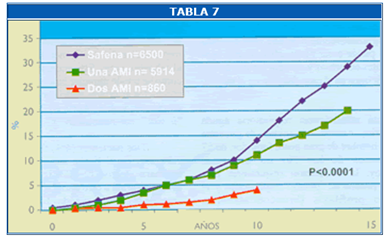
Las re operaciones de coronaria son pues una buena indicación para el uso de conductos arteriales pero se debe analizar bien el problema de flujo sanguíneo, reemplazar una vena enferma y permeable por una arteria puede crear hipoperfusión; en esos casos es mejor dejar los puentes enfermos y agregar los conductos arteriales (35). Eso fue lo que hicimos en el caso descrito en el párrafo precedente.
Un paciente presentó insuficiencia respiratoria aguda (IRA) en el post-operatorio, ocurrió al inicio de nuestra experiencia, se trataba de un hombre de gran peso, fumador, de 57 años. En esa época (inicios de los 90) no usábamos sistemáticamente, como hoy, la evaluación respiratoria pre-operatoria (gases arteriales, prueba de función respiratoria) y el tratamiento preventivo o profilaxis (broncodilatadores, corticoides, ejercicios respiratorios). Actualmente en aquellos paciente en quienes encontramos un riesgo alto de IRA no utilizamos las dos AMI pero si queda la opción de otros conductos arteriales, la AGE o la A.R para acompañar la AMIi que generalmente será colocada “in situ” sobre la principal arteria del ventrículo izquierdo (descendente anterior).
No hemos tenido ningún caso de mediastinitis o de infección esternal profunda o severa. Se debe en parte a la selección de los pacientes y de otra parte a una técnica quirúrgica óptima. El autor está convencido que una coagulación selectiva del lecho de la AMI y el no seccionar los dos bordes de la AMI con cauterio son básicos para no tener mucha zona cruenta que facilite las infecciones; este punto a sido bien desarrollado por Horii (36). Tres pacientes presentaron infección superficial de la herida operatoria y en otro paciente se observó fractura parcial del 1/3 distal del esternón, el cual se reparó, no encontrándose ninguna evidencia de infección.
Un paciente presentó infarto agudo de miocardio post-operatorio (2.2%) sin compromiso de la función hemodinámica, lo cual en cifras de porcentaje es similar a lo encontrado cuando se usan sólo una AMI o exclusivamente venas. El riesgo de espasmo de las AMI es raro (37) nosotros no hemos tenido ningún caso de IMA o una falla hemodinámica aguda, con isquemia evidente. En todo caso se sabe que el riesgo de espasmo de conductos arteriales está más ligado a la técnica de preparación del injerto, y se presenta por lo general al inicio de la experiencia de los grupos quirúrgicos (curva de aprendizaje). Si la arteria tiene un hematoma en la pared, poco flujo o es muy pequeña es más sensato no utilizarla y sustituirla por una vena. El uso de Nitroglicerina por unas horas en el post-operatorio inmediato puede ser útil. Finalmente, consideramos que no se debe salir de sala de operaciones si existen dudas con un injerto arterial, si hay isquemia en el ECG, si alguna zona del ventrículo no se contrae bien o si la PA no es buena (<90 mm. de sistólica). En esas situaciones se deben revisar los injertos, romper el espasmo si lo hay, aumentar la presión arterial (>100 mm de sistólica), que es muchas veces suficiente para hacer desaparecer la isquemia. Si con todas esas maniobras no se logra un estado satisfactorio y seguro del paciente, se debe sustituir el injerto arterial por vena. La ecocardiografía transesofágica intra-operatoria puede ayudar en esos casos a evaluar si existe hipoperfusión regional en una zona irrigada por un conducto arterial.
Un paciente presentó ACV transitorio (2.2%). Se trataba de un varón de 71 años con una aorta ateroesclerótica y placas de calcio que se desintegraban fácilmente de la pared. A pesar de nuestros esfuerzos no se pudo impedir que presentara una paresia del brazo derecho y del miembro inferior del mismo lado, que no le impedían caminar ni comer. El paciente se recuperó íntegramente al cabo de un mes. El porcentaje de complicaciones neurológicas es como se puede apreciar bajo, y además, el uso de dos AMI u otros conductos arteriales podría, ayudar a revascularizar casos donde la aorta es intocable “Aorta en Porcelana” (38), ya sea con dos puentes “in situ” , con puentes en “Y” u otras alternativas.
Dos pacientes (4%) fueron reoperados por sangrado. Esta cifra esta en el límite superior de lo que se espera en cirugía coronaria electiva (2-4%). Tratamos en lo posible de suspender el uso de aspirina u otro antiplaquetario o anticoagulante una semana antes de la cirugía, cuando el estado clínico lo permite; si no es así, utilizamos acido tranexámico o aprotinina durante el intraoperatorio. También evitamos usar transfusiones de sangre homóloga, para lo cual nos servimos de un “recuperador” de sangre (CELLSAVER) que como su nombre lo dice recupera la sangre que se pierden normalmente en el campo operatorio, separa los glóbulos rojos, los lava y los devuelve al paciente en paquetes de glóbulos rojos. De esa forma se disminuye al máximo, a veces completamente, las transfusiones de donantes, que pueden incidir en el sangrado post-operatorio, u otras complicaciones como fiebre, reacciones alérgicas o hemolíticas, síndrome inflamatorio o enfermedades transmisibles.
El seguimiento a largo plazo (9 años) nos ha permitido obtener información de 42 de los 50 pacientes (84%) para conocer la presencia o ausencia de angina, evidencia de isquemia coronaria (Prueba de esfuerzo, Ecocardiograma, Radioisotopos), o de obstrucción de puentes (cateterismo) o revascularizaciones posteriores (Colocación PTCA de Stents, Reoperaciones).
De ocho pacientes (16%) no hemos podido obtener información. De los 42 pacientes restantes (84%), dos pacientes (4%) están asistomáticos sin pruebas objetivas que descarten isquemia coronaria, 40 pacientes (80%) fueron evaluados con prueba de esfuerzo, Ecocardiogrma o Radioisotopos, 37 pacientes (92.5%) de los 40 pacientes tenían ecografía normal o prueba de esfuerzo (-) o prueba de thalium (-). Tres paciente (7.5%) de los 40 presentaron algún tipo de anormalidad. El primer paciente refirió angina con ecografía normal y recibe tratamiento médico. El segundo presentó angina con prueba de thalium (+) en cara lateral; en este caso se había colocado un puente libre de AMI d a la DP, puente “in situ” de AMI i a la DA y no se colocó puente a una arteria lateral por tener la aorta severamente calcificada. Este paciente esta asintomático con tratamiento médico. El tercer paciente tiene prueba de esfuerzo (+) al II estadio de Bruce e isquemia de cara inferior; sus arterias coronarias eran malas, se le colocó un puente de AMI a la DA y un puente libre de AMId a la marginal. No se pudo revascularizar la cara inferior por calcificación total de la CD y la DP. Está asintomático con tratamiento medico.
En conclusión, de 42 pacientes que han podido ser seguidos luego del alta, 39 pacientes (92.8%) no tienen angina o evidencia de isquemía miocardica y llevan una vida normal. Ningún paciente de los que se obtuvo información ha requerido cateterismo cardiaco, revascularización con balón o STENT, ni revascularización quirúrgica. No ha existido mortalidad tardía aunque tenemos ocho pacientes de los cuales no conocemos su situación.
Este trabajo de 50 pacientes consecutivos, con 2 conductos arteriales muestra que la cirugía coronaria con uso de dos mamarias (100% de casos) y otros conductos arteriales se realiza en nuestro medio con excelentes resultados, con baja o nula mortalidad y poca morbilidad. La evaluación a largo plazo de estos pacientes mostró un éxito en el tratamiento del 92.8% de los pacientes evaluados; sin evidencia de enfermedad coronaria recurrente ni necesidad de procedimientos de revascularización secundarios y una sobrevida actuarial a nueve años de 100% en los 42 pacientes evaluados (84% de la muestra). En base a nuestros resultados nos permitimos recomendar el uso de las dos mamarias ya que actualmente es evidente que disminuye la probabilidad de reoperaciones, de procedimientos de revascularización no quirúrgicos y lo que es mas importante disminuye estadísticamente el riesgo de morir en relación a aquellos pacientes en quienes sólo se usa una AMI o venas exclusivamente.
Agradecimiento
Nuestro agradecimiento por su colaboración en el seguimiento de los pacientes, a los doctores: Ricardo Abugattas, Alfonso Bryce, Aldo Castañeda, Ciro Del Rio, José Drago, Juan Dyer, Jaime Espinoza, Raúl Gamboa, César Larrauri-Vigna, Félix Medina, Miguel Sánchez Palacios, Luis Segura, Fernando Tapia, Lourdes Torres y César Veco.
Bibliografía
1. Vineberg, A. Development of an anastomosis between the coronary vessels and a transplanted internal mammary artery. Can Med Assoc J 1941;45:295-8.
2. Vineberg, A. Coronary anastomosis by internal mammary artery implantation. Can Med Assoc J 1958;78:871-4.
3. Favaloro, R; Effler, Cheanvechai, C; Quint, R. and Sones, F. Acute coronary insufficiency (impending myocardial infarction and myocardial infarction). Surgical treatment by the saphenous vein graft technique. Am J Cardiol 1971;28:598-607.
4. Loop, F; Lytle, B;, Cosgrove, D. et al. Influence of the internal mammary artery graft on 10 years survival and others cardiac events. New Eng J Med 1986;314:1-6.
5. Bracamonte, L; Alcántara, C; Aste, H; Malpartida, B; Talledo, O. et al. La mamaria interna en la revascularización miocardica a propósito de 486 casos. Técnica quirúrgica y resultados. Rev Med Hered 1993;4(2):75-80.
6. Barner, H. The internal mammary artery as a free graft. J Thorac Cardiovasc Surg 1973;66:219-21.
7. Bracamonte, L. Cirugía de coronarias. Principios y Terapeútica Quirúrgica. Barboza 1° Edición 1999 Cap 13:606-16.
8. Eagle, K;, Guyton, R. et al. ACC/AHA Guidelines for coronary artery bypass graft surgery JACC 1999; 34(4):1262-347.
9. Kouchoukos, N; Wareing, T;, Murphy, S; et al. Risk of bilateral internal mammary artery bypass grafting. Ann Thorac Surg 1990;49:210-9.
10. Loop, F; Lytle, B. and Cosgrove, D. Free (aorta-coronary) internal mammary graft. Late results. J Thorac Cardiovasc Surg 1986;92:827-31.
11. Accola, K; Jones, E; Craver, J; Weintraub, W. and Guyton, R. Bilateral mammary artery grafting. Avoidance of complications with the extend use. Ann Thorac Surg 1994;57:559-69.
12. Berreklouwe, Ercans, and Koldewijn, E. Similar hospital morbidity with the use of one or two internal thoracic arteries. Ann Thorac Surg 1994;57:1564-72.
13. Cimochowski, Harostock, and Fodes. A 0.7% deep sternal wound infection rate in 658 bilateral interal mammary artery implants: The benefit of avoiding electrocautery and bone wax. J Am Coll Cardiol 1997 (suplement A); 29(2):465.
14. Fiore, A; Keith, N; Dean, P; Kaiser, G;, Pennington, G. et al. Results of internal thoracic artery grafting over 15 years: Single versus double graft. Ann Thorac Surg 1990;49:2002-9.
15. Galbut, D; Ernest, A. and Malcolm, J. Seventeen years experience with bilateral internal mammmary artery graft. Ann Thorac Surg 1990;49:195-201.
16. Lytle, B; Cosgrove, D; Loop, F; Borst, J; Goormastic, M. and Taylor P. Perioperative risk of bilateral internal mammmary artery grafting: Analysis of 500 cases from 1971 to 1984. Circulation 1986;74(suppl)(111):37-41.
17. Cosgrove, D; Lytle, B; Loop, F. et al. Does bilateral internal mammary artery grafting increase surgical risk? J Thorac Cardiovasc Surg 1988;95:850-6.
18. Dion, R; Etienne, P; Verhelst, R. et al. Bilateral mammary grafting: Clinical, functional and angiographic assessment in 400 concecutive patients. Eur J Cardiothorac Surg 1993;7:287-93.
19. Schmidt, S; Jones, J; Thornby, J; Miller, CH. and Beall, A. Improved survival with multiple left-sided bilateral internal thoracic artery grafts. Ann Thorac Surg 1997;64:9-15.
20. Pick, A; Orszulak, T; Anderson, B. and Shaff, H. Single versus bilateral internal mammary artery grafts. 10 years outcome analysis. Ann Thorac Sur 1997;64:599-605.
21. Lytle, B; Blachstone, E; Loop, F; Houghtalino, P; Arnold, J; Akhrass, R. et al. Two internal thorac artery grafts are better than one. J Thorac Cardiovasc Surg 1999;117:855-72.
22. Barner, H. The continuing evolution of arterial conduits. Ann Thorac Surg 1999;68:51-8.
23. Tashiro, T; Nakamura, K; Sukehiro, S; Nakamura, M; Shibano, R; Motomura, T. et al. Midterm results of free internal thoracic artery grafting for myocardial revascularization. Ann Thorac Surg 1998;65:951-4.
24. Tatoulis, J; Buxton, B; Fuller, J. Results of 1,454 free right internal thoracic artery to coronary artery grafts. Ann Thorac Surg 1997;64:1263-9.
25. Buxton, B; Ruengsakulrach, P; Fuller, J; Rosalion, A; Reid, C. and Tatoulis, J. The right internal thoracic artery graft-benefits of grafting the left coronary system and native vessels with a high grade stenosis. Eur J Cardiothorac Surg 2000;18:255-261.
26. Suma, H; Wanibuchi, Y; Furuda, S; Takayama, T. and Furuta, S. The right gastroepiploic artery graft. Clinical and angiographic midterm results in 200 patients. J Thorac Cardiovasc Surg 1993;105:615-23.
27. Grandjean, J; Boonsrtra, P; Den Heyer, P. and Ebels, T. Arterial revascularization with the right gastroepiploic artery and AMI in 300 patients. J Thorac Cardiovasc Surg 1994;107:1309-16.
28. Barra, J; Benzon, E; Mansourati, J; Rukbi, Y; Mondine, P. and Youssef, Y. Reimplantation of the right internal thoracic as a free graft into the left in situ internal thoracic artery (Y procedure). J Thorac Cardiovasc Surg 1995;109:1042-8.
29 . Tector, A; Amundsen, S; Schmahl, T; Kress, D. and Peter, M. Total revascularization with T grafts. Ann Thorac Surg 1994;57:33-9.
30. Royse, A; Royse, C; Groves, K; Bus, B; Yu, G. et al. Blood flow in composite arterial grafts and effect of native coronary flow. Ann Thorac Surg 1999;68:1619-22.
31. Weinschelbaum, E; Gabe, E; Macchia, A; Smimmo, R. and Suarez, L. Total myocardial revascularization with arterial conduits: Radial artery combined with internal thoracic arteries. J Thorac Cardiovasc 1997;114:911-6.
32. Weinschelbaum, E; Macchia, A; Caramutti, V; Machain, A; Raffaelli, H; Favaloro, M, et al. Cirugía de revascularización coronaria con conductos arteriales. Técnica, resultados y seguimiento a cuatro años en 1,023 pacientes consecutivos. Rev Argent Cardiol 2000;68:69-77.
33. Sundt, T; Barner, H; Camillo, C. and Gay, W. Total arterial revascularization with an internal thoracic artery and radial artery T graft. Ann Thorac Surg 1999;68:399-405.
34. Lytle, B. Coronary reoperations. Cardiac Surgery in the Adult. Edmunds, Jr. Mc Graw-Hill 1997;573-96.
35. Navia, D; Cosgrove, D; Lytle, B. et al. Is the internal thoracic artery the conduit of choice to replace a stenotic vein graft? Ann Thorac Surg 1994;57:40-4.
36. Horii, T. and Suma, H. Semiskeletonization of internal thoracic artery: Alternative harvest technique. Ann Thorac Surg 1997;63:867-8.
37. Steen, S. Might free arterial grafts fail due to spasm? ANN Thorac Surg 1991;51:94-101.
38. Leyh, R; Bartels, C; Nötzold, A. and Sievers H. Management of porcelaine aorta during coronary artery bypass grafting. Ann Thorac Surg 1999,67:986-8.
