Noviembre 2017
Talledo O., Torres L., Valenzuela H., Calle A., Mena M., De la Peña O. y Lizarzaburu D.
© 2017 Sociedad de Gastroenterología del Perú
Dolor abdominal persistente por disección de arteria mesentérica superior y tronco celiaco, que no responde a tratamiento conservador
Persistent abdominal pain caused by superior mesenteric artery and celiac trunk dissection that does not respond to conservative treatment
RESUMEN
Reportamos el caso de un paciente varón de 32 años con dolor abdominal recurrente tipo cólico a causa de disección de arteria mesentérica superior (AMS) y tronco celíaco, el cual se resolvió luego de la colocación de 3 stents en AMS. El paciente presentó una clínica atípica lo cual dificultó el diagnóstico. Discutimos la clínica, métodos diagnósticos y alternativas de tratamiento. Iniciamos con un manejo conservador con analgesia, anticoagulación plena, antihipertensivo y control de imágenes, pero al séptimo día luego de reiniciar la vía oral, presenta angina abdominal, por lo cual procedimos a tratamiento endovascular con resultado exitoso y buena evolución, sin eventos, a un seguimiento de 2 años.
Palabras clave: Arteria mesentérica superior; Disección; Dolor abdominal (fuente: DeCS BIREME)..
ABSTRACT
We report the case of a 32 year old male with recurrent colic abdominal pain due to superior mesenteric artery (SMA) and celiac trunk dissection, which resolved after placing 3 stents in SMA. The patient presented atypical clinical signs and symptoms, which made the diagnosis difficult. Clinical presentation, diagnostic methods and treatment options are discussed. We started with conservative management with pain medication, anticoagulation, antihypertensive drugs and image control, but on the seventh day, after restarting oral ingestion, he presented with abdominal angina, after which we proceeded to endovascular treatment with successful results and with an uneventfully 2 year follow up.
Keywords: Mesenteric artery, superior; Dissection; Abdominal pain (source: MeSH NLM).
INTRODUCCIÓN
El tronco celiaco (TC) y la arteria mesentérica superior (AMS) son la primera y segunda ramas importantes de la aorta abdominal, respectivamente. El TC se encarga de proveer de sangre al esófago, estómago, duodeno, bazo, páncreas, hígado y vesícula biliar, mientras que la AMS hace lo propio con el intestino delgado y el colon, desde su origen hasta el ángulo esplénico (1). La disección espontánea de la arteria mesentérica superior o de tronco celíaco es una patología rara, descrita por primera vez en 1947 (2). Se da predominantemente en varones (88,5%), siendo el antecedente más común la hipertensión, presente en el 42,7% de casos (3). No existe hasta el momento una etiología clara sobre esta patología, mencionándose en la literatura la hipertensión, las enfermedades del tejido conectivo y hasta causas mecánicas que tienen que ver con la curvatura de éstas arterias y el ángulo de su nacimiento respecto a la aorta (4,5). Las alternativas de tratamiento
van desde el conservador hasta la colocación de stents e incluso la cirugía abierta, de acuerdo al estado y evolución del paciente (6-15).
CASO CLÍNICO
Paciente varón de 32 años acude al servicio de Emergencia con un tiempo de enfermedad de 3 días, caracterizado por dolor abdominal en epigastrio y náuseas. Refiere además un episodio de deposiciones líquidas. Como antecedentes presenta HTA parcialmente controlada con Losartán y Amlodipino, reducción de fractura de pierna derecha hace 3 años y craneotomía hace 25 años.
Al examen físico presenta funciones vitales estables, leve hipertensión arterial (140/90), abdomen blando y depresible con ruidos hidroaéreos presentes y leve dolor a la palpación profunda en mesogastrio, sin signos peritoneales (Blumberg y McBurney negativos).
Se aprecia hernia umbilical reducible, no dolorosa. Dentro de los exámenes de laboratorio sólo se evidencia elevación de la PCR: 4,9 mg/dl (VN: 0-0,5mg/dl). Se realiza tomografía de abdomen completo con contraste endovenoso, informada como “apéndice cecal de paredes finas, con aire en su interior sin signos inflamatorios, formación quística pararrectal derecha de 25 mm, probablemente relacionado con linfocele y colon descendente de aspecto espástico”. Se hospitaliza en el servicio de Cirugía General con los diagnósticos de dolor abdominal: apendicitis aguda vs gastroenterocolitis aguda, hernia umbilical no complicada e hipertensión arterial. Durante el primer día de hospitalización cursa con dolor abdominal tipo cólico 8/10, al examen físico no hay cambios respecto al ingreso, se aprecia abdomen blando y depresible con dolor a la palpación en mesogastrio que cede con Metamizol e Hioscina endovenosa. No se aprecian cambios en los exámenes de laboratorio salvo la PCR que continúa elevada (6,98). Al segundo día de hospitalización el paciente cursa asintomático y presenta buena tolerancia oral, por lo que se indica alta con diagnóstico final de gastroenterocolitis aguda.
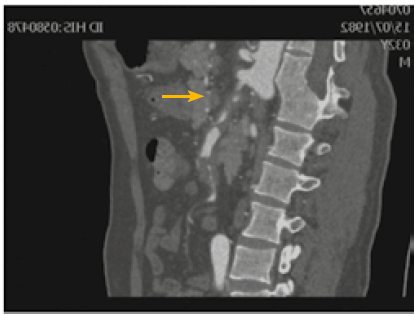
Un día después, el paciente reingresa a Emergencia y es visto por Medicina Interna por dolor abdominal 9/10 en mesogastrio con irradiación a epigastrio e hipogastrio, con un tiempo de enfermedad total de 6 días. Se realiza nueva tomografía, esta vez angiotomografía de aorta abdominal donde se evidencia disección de tronco celíaco y disección de AMS con trombo en tercio distal y obstrucción de 40% de la luz (Figura 1), sin disección de aorta, asociado a edema de grasa mesentérica, sin presencia de líquido libre ni edema de asas. En revisión retrospectiva, se observa suboclusión arterial en tronco celíaco y mesentérica superior que pasaron desapercibidas en tomografía abdominal 2 días antes.
Se hospitaliza en Unidad de Cuidados Intensivos y realizan interconsulta a nuestro servicio. Se decide tratamiento médico, control y manejo estricto de presión arterial (PA) con Nitroprusiato titulable, anticoagulación plena con Enoxaparina 60 mg SC c/12h, analgesia con Tramadol 100 mg endovenoso cada 8 h y Petidina
50 mg EV condicional, programándose control de angioTEM según evolución. Al día siguiente, se añade al tratamiento antihipertensivo Nifedipino 60 mg VO cada 24 horas y luego Telmisartán 80 mg VO cada 24 h y Atenolol 50 mg VO cada 12 h, aumentando la dosis de éste último a 75 mg al cuarto día de hospitalización consiguiendo estabilidad de la presión arterial.
En los primeros 4 días de hospitalización el paciente presenta episodios de dolor abdominal de forma intermitente, algunos relacionados a la ingesta de alimentos y que calman con Tramadol y Petidina. Se aprecia en exámenes de laboratorio que la PCR continúa elevada (5,93), con discreta leucocitosis aislada en el segundo día asociada a único episodio febril (38°), luego del cual se añade al tratamiento Ciprofloxacino 200 mg EV cada 12 horas y Clindamicina 800 mg EV cada 8 horas. Por otro lado, el ácido láctico se encuentra con tendencia a la elevación en los días siguientes, pero manteniéndose dentro de límites normales, siendo al ingreso 7,6 mg/dl y llegando a 13,8 mg/dl durante la hospitalización (VN: 4,5-19,8). La amilasa se mantenía dentro de lo normal, sin mayor variación. Para el quinto día de hospitalización el paciente se encuentra estable, con 24 horas sin dolor, por lo que es dado de alta de UCI, se realiza nueva angioTEM el 6to día, en la cual no se aprecian cambios. Sin embargo, ese mismo día el paciente presenta dolor abdominal intenso tipo cólico no asociado a HTA que calma con Petidina, reapareciendo 5 horas después y tras lo cual se indica nuevamente Petidina y reingreso en UCI objetivándose angina abdominal y donde se decide intervención endovascular electiva.
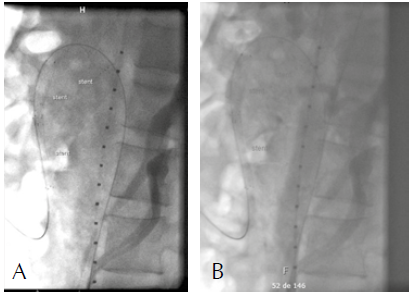
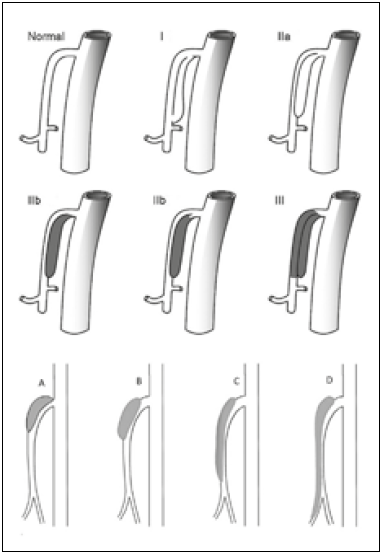
El décimo día de hospitalización se realiza intervención endovascular que inicia con aortografía toraco-abdominal que descarta disección de aorta, arteriografía selectiva de arteria mesentérica superior que confirma disección tipo IIB (Yun) y C (Luan) (Figura 2). Se procede a intervención endovascular con colocación de 3 stents de Nitinol autoexpandibles en forma telescopada de 5×40 mm, 8×40 mm y 8×60 mm para revascularizar 2 estenosis severas por causa de disección. La arteriografía selectiva de AMS y aortografía abdominal post procedimiento muestran resultado exitoso con desaparición de las estenosis y patencia de la arteria mesentérica superior (Figura 3).

A partir del PO inmediato desaparece el dolor abdominal que se correlaciona con disminución del ácido láctico, de 13,8 la mañana del procedimiento a 7,1 en las primeras horas posteriores. Por otro lado, se inicia Clopidogrel 75 mg cada 24 horas luego de 6 horas del post- operatorio y se mantiene el tratamiento antihipertensivo con Atenolol 75 mg VO cada 12 horas, Telmisartán 80 mg VO cada 24 horas y Nifedipino 60 mg VO cada 24 horas además de analgesia con Paracetamol. El tratamiento antibiótico profiláctico con Ciprofloxacino y Clindamicina también continúan. En el PO1 el paciente presenta rash toraco-abdominal luego de la administración de Paracetamol, el cual mejora al suspenderlo. En el PO2 el paciente es dado de alta de UCI sin dolor abdominal y sin tratamiento antibiótico, dándose de alta de la Institución al tercer día post intervención endovascular, manteniendo el Clopidogrel (75 mg VO cada 24 horas), Telmisartán (80 mg VO cada 24 horas), Nifedipino (60 mg VO cada 24 horas) y Atenolol (75 mg VO cada 12 horas) indicados durante la hospitalización. En el seguimiento, dos años después el paciente se encuentra asintomático y sin ninguna molestia.
DISCUSIÓN
La disección espontánea de la arteria mesentérica superior es una patología infrecuente, con una clínica inespecífica caracterizada principalmente por dolor abdominal presente en el 91% de pacientes (3). Nuestro paciente presentó dolor abdominal tipo cólico en epigastrio y mesogastrio, pero además, náuseas y un episodio de deposiciones líquidas. Éstos otros síntomas se presentan en el 19,7% y 3,9% respectivamente, según el estudio de 608 casos de Luan (3).
No existe una etiología clara de esta patología, habiéndose planteado en un inicio como factores de riesgo, la hipertensión o enfermedades del tejido conectivo (3). Sin embargo, Park et al. hicieron estudios hidrodinámicos y simulaciones de los diferentes ángulos de la curvatura de la arteria mesentérica superior (60°, 90° y 120°). Observaron que la mayoría de disecciones aisladas de AMS se dan en la zona convexa de la curvatura de la misma. También relacionaron un aumento de stress en la pared anterior de la AMS cuando el ángulo de la curvatura es menor, por lo que postulan una etiología mecánica (4). Esto va de acuerdo a Luan (2) en el 2015, cuando observó que la mayoría de disecciones de AMS se inicia a 2 cm del origen, siendo ésta la zona que recibiría el mayor stress de la presión de pulso. En el caso del paciente presentado, se aprecia en la angioTEM un ángulo muy agudo de la curvatura de la AMS de 45° y la disección se encontraba a 1,9 cm del origen de la AMS, lo cual va de acuerdo a lo descrito por Park (4) y Luan (2).
Respecto a los exámenes de laboratorio, otros autores (2,5) estiman que la presencia de leucocitosis varía entre un 32,5% y 45,8%, además la elevación de PCR se encuentra presente en 22,7% y 26,3% de pacientes y la elevación de amilasa entre 0,7% y 7,6%. En el caso presentado, el paciente presenta elevación de PCR, leucocitosis solamente el primer día de la segunda hospitalización (11 220) y en ningún momento elevación de amilasa, sin embargo, se evidenció una tendencia a la elevación de ácido láctico con respecto a valores basales sin sobrepasar el límite superior normal que disminuyó tras la intervención.
El diagnóstico se realiza en el 95% de casos por angioTEM, encontrándose como principales hallazgos la presencia de flap de la íntima, trombo mural o hematoma intramural y estenosis excéntrica. Otros hallazgos consisten en el aumento de diámetro de la AMS y atenuación de la grasa alrededor de la misma, los cuales pueden ser signos no específicos en etapa muy temprana (6). En nuestro caso se evidenció una disección tipo IIB, según la clasificación de Yun (7) y tipo C de la clasificación de Luan (6) (Figura 4) las cuales toman en cuenta las características de la disección y la longitud de ésta, respectivamente. Según los estudios, los factores relacionados con la presencia de síntomas en los pacientes son el grado de estenosis de la luz verdadera de la AMS (8) y la extensión de la disección, la cual se ha visto, es menor en pacientes asintomáticos que en sintomáticos (4,5). Esto se explica por la ley de hidrodinámica de Poiseuille, la cual establece una relación inversamente proporcional entre la velocidad de flujo y la distancia, es por eso que mientras más larga la disección, menor es el flujo sanguíneo que llega al tejido, provocando dolor por isquemia (6).
Existen 3 opciones de tratamiento para esta patología: tratamiento conservador, endovascular y quirúrgico. El tratamiento inicial recomendado es el tratamiento conservador, que consiste en observación, antihipertensivos y analgesia (9) y según la mayoría de autores, antiagregación plaquetaria y/o anticoagulación (10-13). Dong et al. recomiendan que la duración del tratamiento conservador sea no menor de 5 días (14) y se han descrito los mejores resultados de esta alternativa en pacientes tipo Yun I y Luan B con 83,3% de éxito en ambos casos (2). El tratamiento endovascular, el cual consiste en la colocación de stents en la entrada de la disección (2), está indicado si persiste la sintomatología (9-11,13,15) generalmente más de 5 días, mientras que la indicación para tratamiento quirúrgico es la presencia adicional de peritonitis y/o necrosis intestinal (10,16,17) o en caso de lesiones inaccesibles por método endovascular o si está contraindicada la angiografía (18). Por otro lado, en todos los pacientes sometidos a procedimiento endovascular y cirugía sin
importar la clasificación, la tasa de éxito fue de 100% (2). Algunos autores recomiendan tratamiento endovascular o quirúrgico como primera línea en disecciones tipo Yun II y III y Luan C y D (6). En nuestro caso se inició tratamiento conservador con anticoagulación plena (60 mg de Enoxaparina SC cada 12 horas), tratamiento antihipertensivo con nitroprusiato titulable, Atenolol, Telmisartán y Nifedipino, analgesia con Tramadol y Petidina durante 7 días, luego de los cuales, por la persistencia de síntomas se procede a tratamiento endovascular con resultado exitoso.
En conclusión, la etiología isquémica por disección aislada de arterias viscerales (TC o AMS) debe ser incluida en el diagnóstico diferencial del dolor abdominal, sobre todo en los casos en los cuales no se encuentre una patología frecuente causal. Los parámetros de laboratorio son relativos. El diagnóstico se realiza mediante angioTEM. Salvo que haya descompensación hemodinámica o complicaciones digestivas graves, el tratamiento de primera línea puede ser conservador, reservándose el tratamiento endovascular o cirugía abierta para los casos en los cuales persistan los síntomas o se prevea que no van a tener buenos resultados con tratamiento conservador según la clasificación de Yun y/o Luan.
Conflicto de intereses: Los autores declaran no tener conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
- Bauersfeld SR. Dissecting aneurysm of the aorta: a presentation of 15 cases and a review of the recent Ann Intern Med. 1947;26(6):873-89.
- Luan JY, Guan X, Li X, Wang CM, Li TR, Zhang L, et al. Isolated superior mesenteric artery dissection in J Vasc Surg. 2016;63(2):530-6.
- D’Ambrosio N, Friedman B, Siegel D, Katz D, Newatia A, Hines Spontaneous isolated dissection of the celiac artery: CT findings in adults. AJR Am J Roentgenol. 2007;188(6):W506-11.
- Park YJ, Park CW, Park KB, Roh YN, Kim DI, Kim Inference from clinical and fluid dynamic studies about underlying cause of spontaneous isolated superior mesenteric artery dissection. J Vasc Surg. 2011;53(1):80-6.
- Luan JY, Li X, Li TR, Zhai GJ, Han Vasodilator and endovascular therapy for isolated superior mesenteric artery dissection. J Vasc Surg. 2013;57(6):1612-20.
- Luan JY, Li X. Computed tomography imaging features and classification of isolated dissection of the superior mesenteric Eur J Vasc Endovasc Surg. 2013;46(2):232-5.
- Yun WS, Kim YW, Park KB, Cho SK, Do YS, Lee KB, et al. Clinical and angiographic follow-up of spontaneous isolated superior mesenteric artery dissection. Eur J Vasc Endovasc Surg. 2009;37(5):572-7.
- Cho BS, Lee MS, Lee MK, Choi YJ, Kim CN, Kang YJ, et al. Treatment guidelines for isolated dissection of the superior mesenteric artery based on follow-up CT Eur J Vasc Endovasc Surg. 2011;41(6):780-5.
- Okamura K, Morizumi S, Kawata M, Suematsu Conservative therapy as a primary treatment for spontaneous isolated dissection of the superior mesenteric artery. Ann Vasc Surg. 2014;28(8):1939-45.
- Li Z, Ding H, Shan Z, Du J, Yao C, Chang G, Wang Initial and middle-term outcome of treatment for spontaneous
isolated dissection of superior mesenteric artery. Medicine (Baltimore). 2015;94(45):e2058.
- Ko SH, Hye R, Frankel Management of spontaneous isolated visceral artery dissection. Ann Vasc Surg. 2015;29(3):470-4.
- Alcantara S, Yang CK, Sasson J, Goss S, Benvenisty A, Todd G, et al. The evidence for nonoperative management of visceral artery dissections: a single-center Ann Vasc Surg 2015;29(1):103-8.
- Lv PH, Zhang XC, Wang LF, Chen ZL, Shi HB. Management of isolated superior mesenteric artery dissection. World J Gastroenterol. 2014;20(45):17179-84.
- Dong Z, Fu W, Chen B, Guo D, Xu X, Wang Treatment of symptomatic isolated dissection of superior mesenteric artery. J Vasc Surg. 2013;57(2 Suppl):69S-76S.
- Galastri FL, Cavalcante RN, Motta-Leal-Filho JM, De Fina B, Affonso BB, de Amorim JE, et al. Evaluation and management of symptomatic isolated spontaneous celiac trunk Vasc Med. 2015;20(4):358-63.
- Wagenhäuser MU, Sagban TA, Witte M, Duran M, Schelzig H, Oberhuber A. Isolated dissection of the superior mesenteric artery treated using open emergency World J Emerg Surg. 2014;9:47.
- Li DL, He YY, Alkalei AM, Chen XD, Kin W, Li M, et al. Management strategy for spontaneous isolated dissection of the superior mesenteric artery based on morphologic classification. J Vasc 2014;59(1):165-72.
- Obon-Dent M, Shabaneh B, Dougherty KG, Strickman Spontaneous celiac artery dissection case report and literature review. Tex Heart Inst. J 2012;39(5):703-6.
Correspondencia:
Alejandro Calle Brush
Av. Alfredo Salazar s/n. Torre de Consultorios. 5to piso. Oficina 504, San Isidro. Lima 27. Perú.
E-mail: [email protected]
