Oscar Talledo Quaglino, Eduardo Payet Meza, Luis Manuel Valdéz Férnandez Baca, Paul Pilco Castañeda, Oscar F. De la Peña Brush
Resumen
El tratamiento convencional de la fístula aortoentérica secundaria a infección de injerto aórtico ha sido: bypass extraanatómico, retiro del injerto infectado y cierre de la aorta abdominal. Evidencia reciente demuestra que, en casos de mínima purulencia, el reemplazo in situ con un nuevo injerto bañado en Rifampicina asociado a envoltura con omento mayor y antibioticoterapia de por vida, permite obtener mejores resultados que el tratamiento clásico. Se presenta el manejo diagnóstico de un paciente de 73 años que ingresó con hemorragia digestiva alta debido a fístula aortoentérica secundaria a pseudoaneurisma e infección de injerto aortobifemoral y el tratamiento quirúrgico con reemplazo in situ del injerto con uno nuevo embebido en Rifampicina. El seguimiento a 1 año mostró buena permeabilidad del injerto, sin signos de reinfección ni hemorragia digestiva.
Palabras clave: Fístula aortoentérica, infección de injerto aórtico, bypass extraanatómico, reparo in situ, injerto bañado en Rifampicina, pseudoaneurisma deinjerto aórtico.
Abstract
Axilo-femoral extra-anatomic bypass and infected aortic graft removal has been the preferred treatment for aorto-enteric fistula secondary to aortic graft infection. Nowadays, there is strong evidence that in situ replacement with Rifampin-soaked graft and omental flap coverage associated with life-time antibiotic therapy has better results than classic treatment. We describe the case of a 73 years old patient with upper gastrointestinal bleeding in whom a diagnosis of aortoenteric fistula associated to aorto-bifemoral graft infection and aortic pseudoaneurysm was made. In situ replacement of the infected graft was performed with a Rifampin-soaked new graft. Follow up at 1 year showed good graft patency and no recurrence of infection or gastrointestinal bleeding.
Key words: Aorto-enteric fístula, aortic graft infection, extra-anatomic bypass, in situ replacement, Rifampin-soaked aortic graft, aortic graft pseudoaneursysm.
Caso clínico
El paciente GSCC es un varón de 73 años que ingresó por Emergencia y fue hospitalizado en la Unidad de Cuidados Intensivos (UCI) de la Clínica Anglo Americana por presentar hemorragia digestiva alta de una hora de evolución. Antecedentes: post operado de bypass aortobifemoral por enfermedad oclusiva aorto-iliaca 10 años antes en otra institución (con anastomosis proximal término-lateral), post operado de bypass aorto-coronario 15 años antes en otra institución, portador de marcapasos, insuficiencia cardíaca congestiva, hipertensión arterial, diabetes mellitus, insuficiencia renal crónica, y anticoagulado con warfarina por fibrilación auricular. Fue admitido con una presión de 127/66, frecuencia cardíaca de 72 por minuto, frecuencia respiratoria de 18 por minuto, afebril y con Escala de Glasgow de 15 puntos. Hemoglobina de 9,4 mg/dL, leucocitos en 7460/mm3 con abastonados 0 %, un INR de 2,77, creatinina de 1,08 mg/dL y hemocultivos negativos.
Fue evaluado por Gastroenterología. La endoscopía digestiva alta resultó negativa. La ecografía abdominal y tomografía espiral multicorte de abdomen con contraste (Figura 1) demostraron fístula aortoentérica secundaria a pseudoaneurisma paraanastomótico proximal de injerto aorto-bifemoral. Encontrándose el paciente hemodinámicamente estable y sin signos de infección grave, anticoagulado y al no contar con Rifampicina endovenosa en nuestro país se decidió diferir el procedimiento, suspendiendo la warfarina, hasta normalizar el INR y conseguir el antibiótico (4 días después), manteniendo expectativa armada bajo estricto control en UCI.
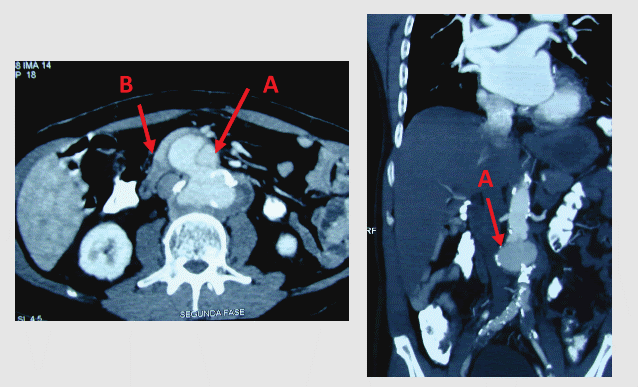
Fue llevado a Sala de Operaciones donde, en forma conjunta, los equipos de Cirugía General y Cirugía Cardiovascular realizaron el manejo quirúrgico.
Recibió anestesia general con tubo endotraqueal y monitorización cardiovascular. Se realizó laparotomía por incisión supra-infraumbilical en línea media. Se liberaron adherencias. Se disecaron y repararon bilateralmente los ramos distales iliacos del injerto antiguo, asegurando control distal. Se notó buena adherencia al injerto con ausencia de secreción en dicha zona. Se heparinizó al paciente. Se realizó clampaje supracelíaco de la aorta antes de disecar y separar el asa intestinal adherida.
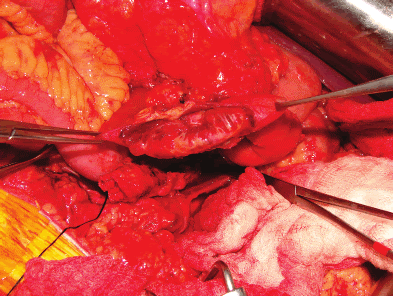
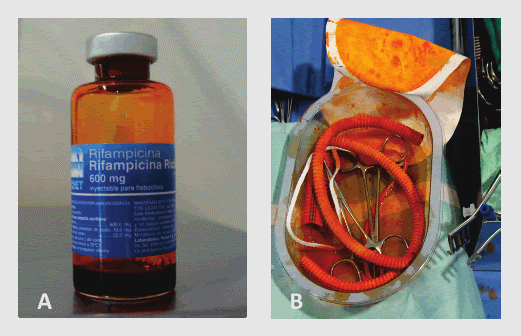
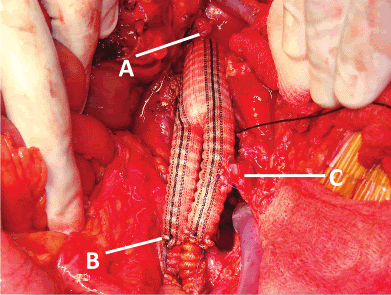
Una vez hecho esto, se cambió el sitio de clampaje a nivel infrarrenal. Se resecó en cuña el área del duodeno que presentaba fístula, entre la tercera y cuarta porción (Figura 2). Se realizó reaproximación intestinal con anastomosis término-terminal en dos planos. Luego se abrió la aorta y se encontró: pseudoaneurima anterior y aneurisma posterior a nivel de la anastomosis proximal del injerto aórtico antiguo (que era término-lateral), los cuales fueron reparados retirando parcialmente los 2/3 proximales del injerto e interponiendo uno nuevo (también de dacrón) in situ, remojado en Rifampicina endovenosa de 600 mg (Figura 3) con anastomosis proximal a la aorta abdominal infrarrenal término-terminal y distal (también término-terminal) a las ramas bien incorporadas del injerto antiguo. Se realizó cierre del muñón distal de la aorta y reimplante de la arteria mesentérica inferior al injerto (Figura 4). Se movilizó un “flap” de omento mayor a través de la transcavidad de los epiplones para revestir el injerto y separarlo de la anastomosis intestinal. Se revirtió la heparina con protamina, se dejaron dos drenes “blacke” 19 Fr en espacios parieto-cólicos derecho e izquierdo y se colocó una sonda naso yeyunal (SNY). Se cerró el abdomen por planos. Se envió el injerto antiguo de aorta para cultivos que resultaron negativos.
El paciente pasó a UCI intubado en ventilación mecánica, hemodinámicamente estable, con soporte inotrópico y cobertura antibiótica endovenosa con Ertapenem y Vancomicina. El primer día post operado se le realizó doppler pletismografía arterial de miembros inferiores obteniendo un Índice Dedo Braquial (IDB) normal (0.5 y 0,66 a la derecha e izquierda) con buena onda digital. Fue extubado y retirado de los inotrópicos al segundo día postoperatorio. Se reinició la vía oral al cuarto día. Con evolución favorable y encontrándose estable, el paciente fue transferido a piso a los 8 días de post operado. El día 14 del postoperatorio fue necesario colocar una nueva SNY y se realizó estudio con contraste oral evidenciando buena permeabilidad intestinal. A los 23 días del postoperatorio fue dado de alta con antibioticoterapia endovenosa: Vancomicina 1g cada 48 horas y Piperacilina/Tazobactam 4 g/0,5 g cada 8 horas; que luego fue cambiada a oral: Linezolid 600 mg 2 veces al día por diez días y luego Trimpetropim/Sulfametoxazol 160mg/800mg dos veces al día de por vida.
Cursó el primer año postoperatorio estable, tolerando vía oral, deambulando, con buena patencia del injerto y sin signos de reinfección. Falleció a los 14 meses de haber sido operado por causa no relacionada.
Discusión
La infección de injerto aórtico es una de las más serias complicaciones en la cirugía reconstructiva arterial aórtica, aunque su incidencia no supera al 1-2 %.
La fístula aortoentérica secundaria es una consecuencia asociada a esta condición en un 20 a 25 % de los casos, reportando una incidencia entre 0,3% a 6% en distintas series (1).
Los factores asociados a la aparición de fístula aortoentérica son: excesivo material de sutura entre el injerto y la aorta, cuello angulado del injerto, un injerto muy largo, no proteger el injerto cerrando el retroperitoneo, entre otros (2).
El diagnóstico de esta patología puede ser difícil, siendo el cuadro principal la hemorragia digestiva alta (65-75%), que puede estar acompañada de signos de infección y demostrarse en muchos casos por estudio tomográfico contrastado del abdomen (3).
Durante la década de los setenta se adoptó la técnica del bypass extra anatómico, retiro del injerto infectado y cierre del muñón aórtico como terapia de elección para tratar esta patología. Cooley, Walker y cols, del Texas Heart Institute introdujeron la técnica de reemplazo in situ del injerto infectado por uno nuevo, presentando en 1987 el resultado de 13 años de experiencia con 23 pacientes operados de fístula aortoentérica con 83 % de sobrevivientes sin morbilidad asociada al procedimiento ni necesidad de amputación, excluyendo además el riesgo de ruptura del muñón aórtico. No reportan casos de reinfección (4). A pesar de ello, la mayoría de cirujanos de la época continuaron utilizando el tratamiento convencional. En 1999 Hayes y cols. (Leicester, Reino Unido) publicaron su experiencia con buenos resultados utilizando por primera vez el reemplazo in situ con injerto embebido en Rifampicina (5). En el 2001 Bandyk y cols. (6) (Vascular Surgery Division, University of South Florida College of Medicine) presentaron un estudio retrospectivo comparando ambas técnicas y utilizando también injerto embebido en Rifampicina. Obtuvieron mejores resultados con el reemplazo in situ en cuanto a la tasa de amputación (9% y 2% respectivamente) y mortalidad postoperatoria (21% y 4%), sin diferencias estadísticamente significativas en cuanto a la tasa de reinfección (3% para ambos).
Oderich y cols. de la Mayo Clinic (Rochester, Minnesota) han publicado 3 estudios retrospectivos desde el 2001 para comparar ambas técnicas, obteniendo resultados a favor del reemplazo in situ del injerto (7,8). En Junio del 2010 presentaron el tercero y más reciente (9), recolectando 18 años de experiencia de la institución con 62 casos de fístula aorto-entérica secundaria a infección del injerto aórtico. Concluyeron que los injertos embebidos con Rifampicina, colocados in situ y recubiertos con un colgajo de omento mayor más antibióticos de por vida, estaban asociados a un bajo grado de reinfección (4%), excelente duración del injerto y salvataje de miembro inferior, siempre y cuando no exista purulencia excesiva y el injerto esté bien incorporado. La remoción del injerto puede ser parcial, limitada a la porción infectada, dejando la porción restante que se encuentra bien incorporada a los tejidos circundantes (lo que se hizo en 23 de los casos publicados).
Conclusión
La evidencia actual está en favor del reemplazo in situ con injerto bañado en Rifampicina y recubrimiento con colgajo de omento mayor, asociado a terapia antibiótica de por vida. Este método tiene menor mortalidad, reinfección y riesgo de amputación debido a una mejor permeabilidad a largo plazo, excluyendo además el riesgo de ruptura del muñón aórtico, en comparación con la clásica técnica de bypass extraanatómico.
El trabajo presentado por el equipo de la Mayo Clinic es el de mayor número de casos y mejores resultados.
Creemos que dicha técnica representa la mejor opción en casos de infección del injerto aórtico con baja purulencia.
Referencias Bibliográficas
- Reilly LM.“Prosthetic Vascular Graft Infection” in Hallet JW et al. Comprehensive Vascular and Endovascular Surgery. 2nd Edition. MOSBY Elsevier. Philadelphia. Chapter 2010;40:688- 713.
- Brooks MJ, Wolfe JHN.“Aorto – enteric fístula” in Parvin S and Earsnshaw JJ. Rare vascular disorders. A practical guide for the vascular specialist. tfm. Shrewsbury, UK. First Edition. Chapter 2005;26:173-180.
- Kashyap VS, O’Hara PJ.Local Complications: Aortoenteric Fistulae in Cronenwett JL and Johnston KW. Rutherford’s Vascular Surgery. Seventh Edition. Society for Vascular Surgery. Saunders Elsevier. 2010:663-674.
- Walker WA, Cooley DA, Duncan JM, Hallman GL, Ott DA, Reul GJ.The Managment of Aortoduodenal Fistula by In Situ Replacement of the Infected Abdominal Aortic Graft. Ann Sur 1987;205:727-732.
- Hayes PD, Nasim A, London NJM, Sayers RD, Barrie WW, Bell PRF, Naylor AR.In situ replacement of infected aortic grafts with rifampicina-bonded prostheses: The Leicester experience (1992 to 1998). J Vasc Surg 1999;30:92-98.
- Bandyk DF, Novotney ML, Back MR, Johnson BL, Schmacht DC.Expanded application of in situ replacement for prosthetic graft infection. J Vasc Surg 2001;34:411-20.
- Oderich GS, Panneton JM, Bower TC, Cherry Jr. KJ, Rowland CM, Noel AA, Hallett Jr JW, Gloviczki P.Infected aortic aneurysms: Aggressive presentation, complicate early outcome, but durable results. J Vasc Surg 2001;34:900-908.
- Oderich GS, Bower TC, Cherry Jr. KJ, Panneton JM, Sullivan TM, Noel AA, Carmo M, Cha S, Kalra M, Gloviczki P.Evolution from axillofemoral to in situ prosthetic reconstrucción for the treatment of aortic graft infections at a single center. J Vasc Surg 2006;43:1166-1174.
- Oderich GS, Bower TC, Hofer J, Kalra M, Duncan J, Ricotta J, Gloviczki P.In situ Rifampin-Soaked Grafts with omental coverage and antibiotic supression are durable with low reinfection rates in patients with aortic graft enteric erosion or fistula. J Vasc Surg 2011;53(1):99-106.
1 Cirujano de Tórax y Cardiovascular. Jefe del Departamento de Cirugía. Jefe del Servicio de Cirugía de Tórax , Cardiovascular e Intervención Endovascular. Clínica Anglo Americana. Lima, Perú. 2 Cirujano Oncológico de Abdomen. Director del Departamento de Cirugía. Instituto Nacional de Enfermedades Neoplásicas. Servicio de Cirugía General. Clínica Anglo Americana. Lima, Perú. 3 Médico Internista. Especialista en Enfermedades Infecciosas y Tropicales. Presidente del Comité de Control de Infecciones y Enfermedades Transmisibles. Clínica Anglo Americana. Lima, Perú. 4 Cirujano General – Oncológico. Servicio de Cirugía General. Clínica Anglo Americana. Lima, Perú. 5 Médico Cirujano. Servicio de Cirugía de Tórax , Cardiovascular e Intervención Endovascular. Clínica Anglo Americana. Lima, Perú.
